El futuro de la ciencia siempre está por hacer y con la COVID-19 iremos hacia el pasaporte biológico individualizado
Como sabemos, la COVID-19 es una enfermedad producida por un coronavirus (SARS-CoV-2), que produce síntomas similares a la gripe con tos seca, fiebre alta y problemas respiratorios. Hoy día, es seguramente el primer tema de conversación al nivel de la sociedad y el más buscado en Google u otros motores de búsqueda. AEPIMIFA, como asociación del sector farmacéutico, sigue aportando su granito de arena en la lucha contra la COVID 19 y, después de las diferentes donaciones que ha podido realizar gracias a la ayuda de todos sus socios protectores, está concentrando sus esfuerzos en informar, de la forma más adecuada, sobre los avances a nivel de vacunas, tratamientos, etc. Así, en esta edición se ha centrado en las respuestas inmunitarias adaptativas. ¿Pero qué es y qué quiere decir?
La inmunidad frente a la COVID-19
A pesar de los grandes esfuerzos realizados a nivel mundial, en la actualidad no existe ningún tratamiento, por lo que la prevención y el correcto manejo clínico de los síntomas más graves son las únicas opciones terapéuticas.
En definitiva, hay una necesidad urgente de educar a la población general en ciencia y tecnología para luchar contra este tipo de desastres que producen un shock económico y social, con cierres empresariales, obligando a trabajadores y al resto de la población a confinarse. En el actual escenario, la COVID-19 afecta a todos los sectores de la sociedad, con grandes pérdidas económicas que van más allá de la propia morbimortalidad asociada a la enfermedad.
Por consiguiente, los responsables de políticas económicas y empresariales esperan un rápido control, para lo cual las estimaciones de inmunidad siguen siendo fundamentales en la calibración del modelo epidemiológico; pero el actual conjunto de herramientas diagnósticas ha demostrado ser limitado para esta tarea.
Existen dos tipos de respuestas inmunitarias adaptativas: inmunidad humoral e inmunidad celular. En ellas intervienen componentes diferentes del sistema inmunitario y sirven para eliminar microbios de distintos tipos.
La inmunidad humoral cuenta con unas moléculas presentes en la sangre y en las secreciones mucosas, como son los anticuerpos producidos por los linfocitos B y capaces de reconocer antígenos microbianos. Son el principal mecanismo de defensa contra microbios extracelulares y sus toxinas.
El virus, una vez que infecta células del hospedador, se replica en ellas, resultando inaccesible a los anticuerpos circulantes. La inmunidad celular está mediada en primer lugar por los linfocitos T, que facilitan la destrucción de microorganismos residentes en los fagocitos o las células infectadas, para suprimir los reservorios de la infección.
Comprender la respuesta inmune completa al SARS-CoV-2 ayudaría a investigadores y personal sanitario a determinar qué aspectos aprovechar.
Por ejemplo, en ensayos llevados a cabo en La Jolla Institute for Immunology (A. Grifoni y cols. ell, 181: 1489–1501, 2020; D. Weiskopf y cols. Sci. Inmunol., 5 (48): eabd2071, 2020), se usaron muestras de sangre de donantes nunca expuestos al SARS-CoV-2, en las cuales los linfocitos reaccionaron igual que los de enfermos de COVID-19: reconocían al agresor y se defendían, ante la exposición in vitro a pequeños fragmentos del SARS-CoV-2.
Una explicación probable es que estas células T reaccionan al virus por exposiciones previas a otros coronavirus del resfriado común (con alta homología respecto del SARS-CoV-2). El sistema inmunológico aprovecharía esa reactividad preexistente, con una respuesta más rápida o mejorada, y podría explicar la alta proporción de asintomáticos (o con sintomatología leve) detectada actualmente.
La especificidad de linfocitos B y T está determinada por receptores específicos de membrana, que reconocen motivos estructurales concretos de las regiones inmunológicamente activas de un antígeno (epítopes). El reconocimiento y ligado del epítope por un receptor celular es el evento que determina la activación específica del linfocito que posee dichos receptores.
Técnicas de diagnóstico del SARSCOV- 2
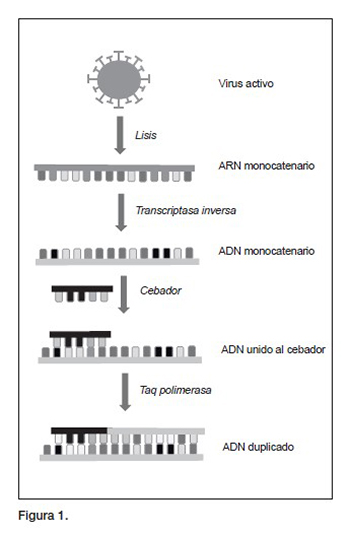
La técnica de referencia para el diagnóstico de la COVID-19 durante la fase precoz es la PCR, que es la reacción en cadena de la polimerasa que viene del acrónimo del inglés Polymerase Chain Reaction. En realidad, se utiliza una variante de la PCR estándar (capaz de amplificar ADN), porque los coronavirus no contienen ADN, sino un ARN monocatenario, recubierto por una estructura de glicoproteínas y lípidos.
Efectivamente, el SARS-CoV-2 se detecta con RT-PCR, usando una enzima denominada transcriptasa inversa, que sintetiza ADN a partir del ARN vírico (figura 1).
La principal limitación del diagnóstico del SARS-CoV-2 mediante RT-PCR es que solo determina infecciones en el momento de la prueba, lo cual significa que no podemos saber si un paciente estaba infectado (o no), días antes de la realización de la prueba, a lo que se añade, que realizar una PCR tiene un alto grado de complejidad técnica y metodológica, por lo que requiere profesionales sanitarios cualificados.
Posteriormente, se puede estudiar el estado inmunitario mediante ensayos rápidos, debido al alto interés para el personal sanitario y la seguridad del resto de la población: reincorporación al trabajo, convivientes inmunodeprimidos, estudios epidemiológicos globales, etc.
Además, habría que recordar que los dos tipos de test que conocemos como test rápidos, tienen bastantes diferencias frente a la PCR tradicional: los test rápidos no identifican el material genético del virus.
Por un lado, mediante una muestra de sangre (obtenida mediante un pequeño pinchazo en el dedo, con una lanceta), el ‘test de anticuerpos’ detecta anticuerpos/inmunoglobulinas producidos por el propio paciente. Conocido como test rápido de la ‘gotita de sangre’, esta se pone en un receptáculo que, de forma cualitativa, diferenciará los anticuerpos lgG e lgM. Ese tipo de test se basa en una inmunocromatografía en papel: una plataforma que tiene ‘pegadas’ las proteínas del virus, para detectar anticuerpos específicos que son proteínas del virus. Su funcionamiento es similar al de los test de embarazo.
El segundo método, ahora también conocido como ‘PCR rápida’ se realiza a través de muestras respiratorias de exudado nasofaríngeo y, en este caso, se trata de detectar proteínas (antígenos) del virus y no su material genético.
Son dos tests que utilizan técnicas totalmente diferentes y cada uno tiene su razón de ser, en función de la información que se desea obtener (figura 2).

A continuación (figura 3), se muestra la recomendación de la SEPAR (Sociedad Española de Neumología y Cirugía Torácica) para recogida de muestras en vías altas respiratorias (por profesionales sanitarios), para el diagnóstico de la infección por SARS-CoV-2 (COVID-19).

Aunque con ventajas (sencillez, rapidez, etc.), los inmunoensayos de flujo lateral de detección cualitativa del SARS-CoV-2, en muestras sanguíneas (anticuerpos) es una tecnología muy discutida actualmente para su uso como prueba diagnóstica fiable.
Incluso con limitaciones (en muchos casos con sensibilidades muy inferiores al 80%), pueden ser útiles para detectar contactos con el SARS-CoV-2, aunque no permitan conocer en qué fase de la infección está el paciente.
Además, se desconoce si niveles de anticuerpos reconocibles como positivos en test serológicos aseguran la inmunización/protección frente a nuevas oleadas del virus y, si es así, cuánto tiempo permanecen esos anticuerpos, si son neutralizantes o bloquean al virus.
Fan Wu y cols. (BMJ, Yale. 30.03.2020) detectaron anticuerpos neutralizantes en todos los enfermos estudiados tras 10-15 días del inicio de síntomas. Además, experimentos realizados en China (Long, Q. y cols. Nat Med 26: 1200–1204, 2020) evidencian que más del 90% de participantes (sintomáticos y asintomáticos) tuvieron descensos de anticuerpos específicos del SARS-CoV-2 (inmunoglobulina G/IgG) en 2-3 meses desde el inicio de la infección.
Por ello, la OMS recomienda usar estos ensayos solo en investigación y, en el caso de los anticuerpos, para estudios epidemiológicos. Pero no deberían usarse como la única base para el tratamiento u otras decisiones de manejo del SARS-CoV-2. Aun así, el Ministerio de Sanidad aprobó los test antigénicos para diagnóstico/cribado, pese a la baja fiabilidad de las pruebas de antígenos en pacientes asintomáticos, en los primeros días de infección o una vez transcurridos 5-7 días tras la aparición de los síntomas.
Tecnologías alternativas de diagnóstico del SARS-COV-2
Los tiempos de COVID-19 son una posible oportunidad para mejorar, abordando nuevos proyectos con visiones diferenciadoras de futuro, que aporten claridad y sencillez en los procesos de diagnóstico.
La aparición de nuevas olas epidémicas de SARS-CoV-2 dependerá, por un lado, del virus y su propia capacidad de mutación/adaptación y, por otro, de nuestra capacidad para trasmitirlo y controlarlo.
Como ya se dijo, está probada la existencia de anticuerpos en pacientes asintomáticos, pero los títulos de anticuerpos neutralizantes fueron muy variables. Incluso, en algunos pacientes no se detectó su presencia, quizás por concentraciones de anticuerpos neutralizantes por debajo del umbral de detección del test rápido.
Resulta más fiable chequear anticuerpos mediante ensayos de inmunoabsorción ligados a enzima (ELISA/Enzyme-Linked ImmunoSorbent Assay), realizados en placas de 96-pocillos, que permiten medir múltiples muestras en cada experimento. Estas placas deben tener propiedades especiales para asegurar que el anticuerpo o el antígeno se adhieren a su superficie. Estas pruebas permiten cuantificar la presencia de anticuerpos en la sangre de los pacientes (como el test rápido de la gotita de sangre), con una elevada sensibilidad. Por ello, es capaz de detectar los verdaderos positivos: por su alta sensibilidad, tiene pocos falsos negativos y su especificidad implica pocos falsos positivos. Pero este test tiene que ser realizado por profesionales, con equipos e instalaciones específicas en laboratorio.
Aunque la protección se consigue mediante una respuesta conjunta humoral/celular, hay pocos datos sobre inmunidad celular en SARS-CoV-2, a pesar de que otros coronavirus (MERS y SARS-CoV-1) produjeron una inmunidad de células T duradera, aunque con respuestas de anticuerpos relativamente efímeras. Por ello, algunos autores especulan que, en el SARSCoV-2, la memoria de las células T puede durar años y ser crucial para una respuesta inmunitaria protectora.
Consecuentemente, se han introducido diversas tecnologías para estudiar respuesta inmunitaria celular frente a la infección viral. Tal sería el caso del ‘inmunospot’ ligado a enzimas (ELISPOT) y de la citometría de flujo, que es una técnica muy potente, aunque compleja, que permite determinar subconjuntos de células T implicadas en la protección.
En este sentido, muy recientemente se han detectado (J. Mateus y cols. Science 370: 89–94, 2020), mediante citometría de flujo, linfocitos T (CD4+ SARS-CoV-2–reactivos) en individuos nunca expuestos a la COVID-19, sugiriendo, de nuevo, una protección cruzada, por la presencia previa de células T de memoria (hasta en un 20-50% de la población).
Además, se están desarrollando otros ensayos de detección de SARS-CoV-2 muy prometedores. Sin embargo, como aún no hay resultados clínicos, no podríamos considerarlas como técnicas de diagnóstico validadas en este momento. Tal sería el caso de la detección mediante el sistema CRISPRCas13 o de la tecnología FACTS (Facile Automated Coronavirus-sensitive T-cells Screening), que permitiría una cuantificación de muestras de sangre periférica entera, con capacidad para miles de muestras diarias. Así, se podría avanzar en el diagnóstico de inmunidad duradera, la efectividad de futuras vacunas o la importancia de reacciones cruzadas frente a otros coronavirus. Todo ello, por una fracción del precio de los ensayos actuales y sin necesidad de muestreos por personal sanitario especializado. De este modo, se simplificarían flujos de trabajo en laboratorio, acelerando la identificación de biomarcadores inmunológicos que se asocien con el pronóstico y tratamiento de los pacientes.
Gracias a este tipo de nuevas tecnologías, se debería implementar un método in vitro fiable, reproducible, rápido y factible, para evaluar las respuestas inmunes celulares humanas a SARS-CoV-2 o a cualquier otro patógeno de los que se conoce relativamente poco y para los cuales no existen vacunas ni tratamiento. Esto incluye otros coronavirus humanos (como SARS y MERS), a enfermedades (como tuberculosis, influenza aviar, dengue, zika, ébola, etc.) e, incluso, a otros virus zoonóticos con potencial pandémico en humanos (Caitlin E. y cols. Proc. Nat. Acad. Sci. Oct 2020, 202001046).
Evidentemente, tecnologías como FACTS podrían introducir un ‘pasaporte biológico’ fiable y útil para que las organizaciones (gubernamentales y/o privadas) planifiquen una vuelta segura al trabajo, detectando de forma inequívoca a pacientes actualmente infectados, a aquellos expuestos de algún modo o los que han desarrollado inmunidad, lo que facilitaría la detección y clasificación de la población infectada, en riesgo o inmune.
.jpg)
Con ello, romperíamos la barrera que nos impide volver a nuestras vidas normales, porque nuevos brotes de coronavirus seguirán conmocionando a las economías y, a medida que la pandemia global se agudice, el coste socio-económico frente a la COVID-19 aumentará. Consecuentemente, no solo gobiernos, también empresas de cualquier sector están obligados a actuar protegiendo a empleados y clientes y minimizando daños económicos.

El pasaporte biológico individualizado
Esta pandemia está arrojando luz sobre lo que realmente debería significar tener una cultura de seguridad sanitaria, mejorando la cobertura de las rutas de transmisión microbiana, diagnóstico del paciente y toma de decisiones médicas. También impulsando nuevas necesidades de optimización y estandarización de la capacidad de cribado, mediante la automatización y validación de protocolos optimizados en tiempo real. Para ello, se necesitan tecnologías de alta capacidad, con nuevas eficiencias, que acorten tiempos de respuesta y reduzcan costes.
En definitiva, la COVID-19 está planteando preguntas sobre el impacto del pensamiento regulatorio, tradicionalmente conservador y con aversión al riesgo, para el diagnóstico de enfermedades.
Al contrario de las viejas formas, para navegar por el camino post-COVID hacia la ‘nueva normalidad’, está creciendo un inesperado interés por la experiencia del mundo real. Avanzando hacia nuevos incentivos científicos, operativos y/o financieros, las empresas deben transformar rápidamente ‘comportamientos tradicionales’ y adoptar nuevos métodos, promoviendo simultáneamente enfoques tradicionales y nuevas modalidades.
Por ejemplo, en medios políticos se viene hablando de la posibilidad del ‘pasaporte biológico’, para detectar contagios y asegurar la posterior inmunidad del individuo. Sin embargo, algunos expertos lo consideran un posible “generador de desigualdades, de escasa efectividad ante las dudas de la inmunidad”. Efectivamente, en la actualidad solo se podría obtener un ‘pasaporte serológico COVID’, ya que, desde un punto de vista sanitario, las pruebas clínicas disponibles (PCR y tests serológicos) solo permiten analizar parte de la respuesta inmunitaria frente al virus, que no es el único mecanismo de protección. Además, socialmente, las actuales pruebas de diagnóstico pueden acarrear problemas: los falsos positivos etiquetan erróneamente a personas sanas como infectadas (con cuarentenas innecesarias e inútiles rastreos), mientras que los falsos negativos tienen consecuencias más graves, porque las personas infectadas, que pueden ser asintomáticas, podrían no estar aisladas, con el riesgo de infección a terceros y dispersión de la enfermedad.
Consecuentemente, no puede descartarse el papel de la inmunidad celular y de tecnologías factibles para detectar la inmunidad mediada por células, puesto que las respuestas inmunitarias adaptativas tempranas se correlacionan con mejores resultados clínicos.
En definitiva, resulta esencial poner en marcha tecnologías rápidas, sencillas, automatizadas y de alta capacidad, que usen equipo de laboratorio estándar, en lugar de complejas infraestructuras de tipificación sanguínea, donde bastase con la extracción de unos microlitros de sangre venosa, sin necesidad de personal sanitario altamente capacitado.
Sacando del laboratorio este tipo de tecnologías innovadoras, podremos ponerlas en primera línea de la lucha contra la COVID-19, para construir un futuro sostenible y justo para todos, sobre todo, para países de bajos ingresos, en los que se puedan utilizar en cualquier entorno que cumpla con los requisitos especificados en las instrucciones de uso y la normativa local.
Hoy en día, el pasaporte biológico individualizado puede parecer ser un sueño, pero hemos visto con qué rapidez ha reaccionado el sector biofarmacéutico en la lucha contra la COVID 19 y, quizás, dentro de muy poco lo tendremos.
| Nombre | |
|---|---|
| Empresa | AEPIMIFA |
| Cargo |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO

















































