Estrategias para la cualificación de un biocida en superficie según Anexo 1 EU GMP
En el artículo ya publicado en Farmespaña Industrial titulado Algunos aspectos sobre la elección de un biocida para una zona aséptica farmacéutica de la UE, se analizó que elegir un biocida es una decisión muy relevante en la industria farmacéutica, sobre todo si está destinado a desinfectar zonas y superficies críticas o bien herramientas destinadas a estar en contacto indirecto con el producto.
Hace meses se publicó otro nuevo borrador del Anexo I GMP. Se espera que entre en vigor pronto y se tiende a creer que sufrirá muy pocos cambios en su versión final.
La cualificación de un biocida es un proceso complejo. Con este artículo se pretende profundizar sobre el texto del borrador relativo a la cualificación de un biocida que aparece en los puntos 4.36, 4.37 y 4.38.
Como ideas clave en cualificación de biocidas destacan:
- Debe haber un SOP por escrito y bien detallado sobre el proceso de limpieza y desinfección (“they should be cleaned and disinfected thoroughly in accordance with a written programme” y “The disinfection process should be validated”).
- Un biocida debe ser cualificado para demostrar su eficacia contra todo tipo de microorganismos que puedan afectar al producto (“to ensure that where they have different modes of action and their combined usage is effective against all bacteria and fungi”). Normalmente se trata de bacterias y hongos (o sus esporas), aunque en algunos casos puede haber virus implicados, sobre todo en terapia celular, y más teniendo en cuenta las circunstancias epidemiológicas actuales.
- Un esporicida debe estar en la rotación y cualificarse (“disinfection should include the periodic use of a sporicidal agent”).
- Se debe identificar los microrganismos presentes en la monitorización ambiental para detectar cambios en las cepas y sus tendencias (“to detect changes in types of microbial flora”). Estas identificaciones son cruciales. Más adelante se desarrollará.
- La cualificación se debe hacer con los biocidas tal y como se van a utilizar (“Validation studies should demonstrate the suitability and efectiveness of disinfectants in the specific manner in which they are used”). Esto puede ser un punto de confusión, pero el sentido común y el conocimiento científico apuntan a que se realice la cualificación con el formato elegido (listo para su uso, concentrado, monodosis, pulverizador, bidón, mopa, toallita presaturada…) y en las condiciones reales, es decir, con los tipos de superficie, cepas autóctonas, tiempos de contacto comprobados (no teóricos), criterios de aceptación científicos adaptados a la industria, condiciones limpias o sucias…
- Se debe cualificar el biocida próximo a su fecha de caducidad de fabricación (“and should support the in-use expiry periods”), ya que es el peor caso posible en su eficacia y estabilidad. Los desinfectantes pierden eficacia a medida que pasa el tiempo debido a la natural degradación química o bien, por ejemplo, a interacciones con la cara interna del envase plástico o con su bolsa interna si son pulverizadores. Estas afectaciones suelen ser más habituales en los productos listos para su uso, aunque no son exclusivas de estos formatos.
- En caso de que los biocidas sean concentrados, deben ser validados para determinar su vida útil máxima una vez diluidos por el usuario, ya que se degradan al estar en contacto con agua y pueden estar contaminados si el proceso no se ha controlado correctamente (“Dilutions should be kept in previously cleaned containers and should only be stored for defined periods”).
Puede haber múltiples razones para cambiar/introducir un biocida en la rotación, por lo que debe procederse a su cualificación. Algunas de ellas pueden ser:
- Adecuación a las normativas (por ejemplo el nuevo Anexo 1 EU GMP).
- Cambios notables en la identificación de las cepas autóctonas detectadas durante la monitorización ambiental (en adelante, EM) o bien en sus tendencias.
- Observaciones de las auditorías externas e internas.
- Introducción de un esporicida en la rotación.
- Necesidad de un proveedor de suministro ‘B’ para prevenir una posible descontinuación de la cadena de suministro o bien poder adquirir más biocida ante eventuales demandas urgentes de suministro.
- El biocida degrada las superficies o utensilios de trabajo sensiblemente.
- Peligro para la salud de los operarios.
- Incompatibilidad entre biocidas.
- Descontinuación de la fabricación de biocidas por parte del proveedor. Esto podría ser debido, por ejemplo, a la no renovación del registro que permite poderlos comercializar o bien por renovación de su portfolio comercial.
- Con las circunstancias actuales, y en según qué sectores farmacéuticos, existe la posibilidad que se requiera un biocida con capacidad viricida demostrable.
- Optimización y/o racionalización de la rotación de biocidas.
- Hallazgo de un biocida idéntico a uno que se emplee en la actualidad, pero con ventajas técnicas y/o económicas y/o de suministro (cualificación like-to-like).
Hay varios factores a tener en cuenta para realizar una correcta cualificación de biocida, pero cada caso debe considerarse individualmente. Un buen punto de partida es el siguiente:
- Disponer de las cepas autóctonas identificadas en la EM, así como sus tendencias. Es un aspecto clave y muy apreciado por las inspecciones farmacéuticas en la investigación de desviaciones, facilitando en gran medida la identificación de la causa-raíz de una contaminación por partículas viables. Por otro lado, asiduamente las cepas autóctonas son más difíciles de eliminar/reducir en los estudios de cualificación que las cepas oficiales listadas en la colección más comúnmente referenciada (ATCC). Por ello, las cepas autóctonas constituyen el peor caso posible en los estudios de cualificación.
- Obtener recortes de las superficies originales de las instalaciones y envejecerlas hasta parecerse lo más posible a las superficies actuales, en caso que la planta ya esté en uso. Si no fuera posible disponer de recortes originales, usar superficies lo más parecidas posibles realizando un análisis de riesgos adecuado.
- Comprobar el tiempo de contacto del biocida en las condiciones reales, llevando a cabo una prueba industrial en, por ejemplo, la/s línea/s de fabricación más crítica/s. Para validar el tiempo de contacto se recomienda el uso de un vídeo ‘time-lapse’ que pueda ser mostrado a las inspecciones. Si no se ha grabado un vídeo, podrían usarse los tiempos de contacto de las diferentes normas de eficacia biocida (normalmente EN13697), pero esto puede ser señalado negativamente por los auditores al no ser tiempos representativos de la realidad de la planta.
- Decidir el/los formato/s que se van a utilizar. Normalmente están listos para su uso, concentrados, pulverizadores, monodosis, bidones, mopas o toallitas presaturadas.
- Definir unos criterios de aceptación de reducción logarítmica adaptados a la industria farmacéutica, ya que los criterios de la norma EN13697 están alejados de la realidad científica de las salas blancas o las zonas asépticas. Un ejemplo de reducción logarítmica para la cualificación en superficie según EN13697 es:
- 3 log para bacterias.
- 2 log para hongos y levaduras.
- 2 log para esporulados.
- Realizar una evaluación de proveedores adecuada antes de empezar todo el proceso. Por ejemplo, comprobar si ya se cumple BPR (Biocidal Products Regulation) o bien si se está llevando a cabo el proceso por parte del proveedor. Por otro lado, un dossier técnico robusto del biocida refleja su idoneidad para la industria farmacéutica (características técnicas, trazabilidad, etiquetado, referencias al Quality Manual del fabricante, registro ante autoridades legales…).
- Testear un mínimo de dos lotes de diferentes depósitos madre del biocida concentrado, recomendándose tres lotes para demostrar su reproducibilidad en la eficacia entre lotes. Para mayor seguridad se recomienda testearlos cerca de su fecha de caducidad (2-3 meses antes de dicha fecha o bien el peor caso posible en condiciones de uso real).
- Tener en cuenta que es posible que no todas las superficies consigan la misma reducción logarítmica. Por ejemplo, las superficies plásticas o poliméricas son más difíciles de desinfectar, ya que están compuestas de agujeros vistos al microscopio electrónico (Fig. 1), así que nuestros ojos no lo pueden observar. Esta característica física dificulta la penetración del biocida en el microorganismo ya que puede ‘esconderse’ en estos agujeros. Es importante considerar las características físicas de la superficie, valorando también su degradación/edad.
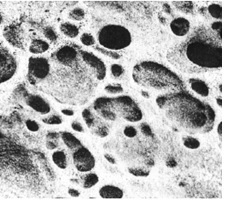
Fig. 1. Fotografía de cortina plástica vista al microscopio
- Una vez realizados todos los estudios de eficacia en el laboratorio (Fase II) es necesario testear los productos ‘in situ’ con el procedimiento real que se va a llevar a cabo en la planta (Fase III), para demostrar la idoneidad de la elección y validar el proceso fielmente.
Excepto en contadas ocasiones, la cualificación de un biocida se refiere normalmente a su eficacia bactericida, fungicida y/o esporicida en superficie, pero raramente se evalúa la eficacia viricida. Por la situación que se está viviendo actualmente quizá se requiera determinar este tipo de eficacia. Para la eficacia viricida se tendría en cuenta la norma EN14476 (aunque esta norma se refiere a un ensayo en suspensión), y para las demás eficacias se utiliza la EN13697 (no existe norma de eficacia esporicida en superficie, pero puede usarse una adaptación de esta norma).
Es importante recalcar que una buena estrategia de cualificación conllevará una disminución de los costes de no-calidad de la compañía, al verse reducidas las desviaciones, investigaciones de causa-raíz y los CAPA correspondientes.
En todo caso, la desinfección solo es un aspecto más del control global de contaminación en la industria farmacéutica. Es también crítico el entrenamiento al personal, el procedimiento de vestuario, la correcta transferencia de materiales, una apropiada ejecución de los análisis de riesgos… entre otros aspectos.

| Nombre | Marc García |
|---|---|
| Empresa | |
| Cargo | Consultant of CCS in Pharmaceutical Industry / QA Senior |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO

















































