Eliminar el riesgo de contaminación en la fabricación de productos biológicos con la tecnología SBV
El mercado mundial de CMO está creciendo a una TCAC (CAGR) del 12-13 por ciento entre 2018 y 2022. Esto se atribuye al aumento de la contratación a terceros a la hora de producir medicamentos genéricos por parte de las grandes empresas farmacéuticas. Además, las medianas y pequeñas empresas farmacéuticas y biofarmacéuticas, que no poseen la infraestructura adecuada, también subcontratarán, impulsando así el mercado. En la actualidad, la fabricación de medicamentos no estériles domina el mercado mundial de las CMO. Sin embargo, se espera que el mercado de fabricación estéril crezca a un ritmo mayor (15%) que el mercado no estéril (9%) hasta 2022 (1).
Entornos de fabricación
A medida que aumenta el número de productos farmacéuticos estériles, los entornos de fabricación se enfrentan al reto de garantizar que se establezcan medidas de control adecuadas para mitigar las muchas potenciales fuentes de contaminación. Entre ellas figuran los operadores, el equipo y otros materiales presentes en el entorno de fabricación. En caso de entrar microorganismos, partículas o endotoxinas en el entorno de fabricación, la seguridad de los pacientes podría correr peligro. A lo largo de los años se han desarrollado tecnologías para asegurar la transferencia estéril de los productos y su sustancia farmacológica durante el procesamiento aséptico. Entre los ejemplos se incluyen los sistemas de barrera con acceso restringido (RABS) y los aisladores. Los RABS proporcionan una barrera entre las líneas de procesamiento y los operarios y permiten interactuar con los productos donde sea necesario. Los aisladores proporcionan una barrera hermética alrededor de la línea de procesamiento y, al utilizarse en entornos de salas limpias, pueden reducir el riesgo de contaminantes. Pero tanto las tecnologías de RABS como las de los aisladores tienen desventajas. La transferencia de materiales puede ser un proceso difícil cuando se utiliza un aislador, lo que puede retrasar el proceso de parada y arranque entre lotes, y la tecnología RABS se basa en procesos de limpieza manual, lo que puede crear retrasos entre usos si no se gestiona cuidadosamente.
Las ventajas de la tecnología de válvula de mariposa dividida (SBV).
La válvula aséptica de mariposa dividida (SBV) proporciona un método seguro para transferir una sustancia farmacológica o producto de un contenedor, recipiente de procesamiento, aislador o RABS a otro, asegurando que la esterilidad de la transferencia no se vea comprometida.
Fundamentalmente la SBV consiste en dos mitades, la unidad activa (Alfa) y la unidad pasiva (Beta). Cada unidad forma una mitad del disco ‘mariposa’. La unidad activa está conectada al equipo de proceso estacionario, como un recipiente de mezcla, mientras que la unidad pasiva está conectada al contenedor móvil, como un contenedor intermedio para productos a granel (IBC) o una bolsa flexible. Cuando se unen las dos partes, las mitades del disco pasan a formar uno solo, sellando cualquier superficie que pueda haber estado expuesta a un compuesto durante la transferencia. Los dos discos funcionan entonces como uno y pueden abrirse para permitir la transferencia del producto de un lugar a otro.
El diseño único de la SBV aséptico permite que la descontaminación tenga lugar en un entorno cerrado. Una vez sellado, se crea un espacio entre los discos y el gas de peróxido de hidrógeno es expulsado a través de este recinto para descontaminar el espacio. Se utilizan indicadores químicos (Cis) para validar y confirmar que se ha logrado la cobertura total del recinto, seguido del uso de indicadores biológicos (BIs) para asegurar que se ha logrado una reducción del 99,9999%, conocida como reducción 6-log, en las esporas bacterianas.
La introducción/adopción/implementación de la tecnología de SBV aséptica permite a los fabricantes beneficiarse de un método de manipulación cerrado que no solo alcanza el nivel de garantía de esterilidad (SAL) requerido y reduce la necesidad de intervención manual, sino que también ofrece la oportunidad de reducir el recurso asociado a la limpieza y validación de grandes áreas. El método reduce al mínimo los requisitos de limpieza y, por consiguiente, el tiempo de inactividad, al tiempo que aumenta el flujo y el rendimiento de las transferencias de productos.
El tiempo de procesamiento varía entre cuatro y 30 minutos, según el sistema de gasificación utilizado. Esto es extremadamente rápido si se compara con una esclusa o aislador convencional que podría estar en un intervalo de 4 a 6 horas. Las SBV también pueden contribuir a reducir considerablemente los costos en comparación con los métodos tradicionales, siendo de tres a cinco veces más baratas que los métodos alternativos. La SBV aséptica también permite reducir la calidad del entorno de la sala limpia circundante debido a la integridad del enfoque.
Caso de estudio
Adición estéril de API a un recipiente de mezcla
Una CDMO norteamericana requería una solución para asegurar la transferencia estéril de los API en sus instalaciones.
La CDMO es una empresa farmacéutica ‘full service’ que se especializa en el suministro de productos respiratorios y oftálmicos. Sus capacidades se extienden mucho más allá de la fabricación, con un equipo de desarrollo interno especializado en todos los aspectos de la puesta en el mercado de un producto, desde lotes de escala de laboratorio, tramitaciones reglamentarias, scale-up, fabricación y distribución.
Desafíos iniciales
La CDMO buscaba resolver la carga de una sustancia farmacológica estéril en un tanque de mezcla. Se trata de un problema extendido en la preparación aséptica y, en particular, en la formulación.
Era vital que se mantuvieran las condiciones estériles mientras se acoplaba un contenedor al recipiente y luego se transfería la sustancia farmacológica sólida para formar una suspensión líquida. Con un líquido totalmente disuelto, el producto podía filtrarse de forma estéril cuando se pasaba al llenado. Aunque en este caso, el producto que se pasaba al punto de llenado era una suspensión y, por lo tanto, esta opción no era posible.
Esto requería que el proceso se realizara en condiciones asépticas. Así, era necesaria una de las siguientes mejoras:
- Mejorar toda la sala a una sala limpia de grado A desde un grado C.
- Introducir un área de grado A sobrepresurizada alrededor del punto de llenado y mejorar toda la sala a un espacio/ambiente de grado B.
- Implementar un sistema de flujo laminar alrededor del punto de llenado, además de un control adicional debido a la falta de una barrera.
- Introducir un sistema RABS en el punto de llenado o en el recipiente lleno y mejorar la habitación a un espacio/ambiente de grado B.
- Mantener la sala limpia de grado C pero introducir la tecnología de aisladores alrededor del punto de llenado o del recipiente lleno.
En general, los RABS y la tecnología de aisladores probablemente se habrían visto favorecidos en esta situación, debido a los beneficios que ambas tecnologías pueden ofrecer. Esto incluye la mejora de la garantía de esterilidad, empleando las técnicas fundamentales de separación y descontaminación. Sin embargo, al considerar algunas de las desventajas asociadas a estas tecnologías, como la elevada inversión inicial, el espacio, la ergonomía y el continuo costo y consumo de energía, la empresa decidió buscar una solución más adecuada.
La solución
La válvula ChargePoint AseptiSafe Bio fue seleccionada como una solución ideal para este problema. La válvula proporcionó una transferencia de polvo sellada montada en el puerto de entrada del recipiente. La válvula podía ser esterilizada previamente con vapor junto con el recipiente, a diferencia de las SBV tradicionales u otras conexiones convencionales (figuras 1A y 1B). En la conexión final, también eliminaba cualquier contaminación de la sala de las caras de contacto de la transferencia de forma controlada y validada (figuras 2A y 2B).

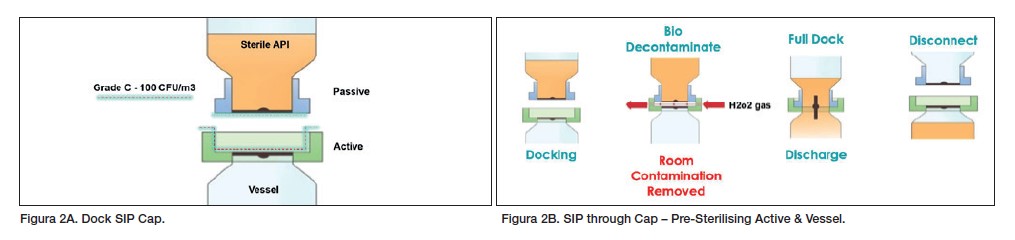
La válvula AseptiSafe Bio funciona creando una cámara sellada entre la sección pasiva (contenedor de transferencia) y la sección activa (recipiente). La cámara sellada se descontamina biológicamente con peróxido de hidrógeno vaporizado (VHP) cuando las dos mitades se acoplan.
Esto elimina cualquier contaminación biológica a una reducción validada de 6-log y deja el espacio y las caras de contacto limpias y listas para acoplarse. Una vez acoplado, el disco puede ser abierto. Esto permite que el producto se transfiera de forma segura de un contenedor de transferencia al recipiente, eliminando el riesgo de contaminación. Realizar esta transferencia dentro del espacio de grado C proporcionó considerables beneficios de costo y producción.
Validación del proceso
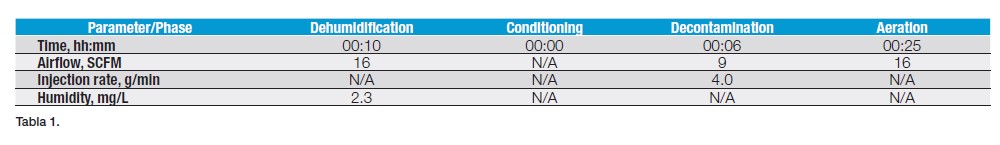
El primer paso para validar microbiológicamente el proceso fue generar un ciclo de descontaminación validado para la etapa de gaseado de VHP. Este consistía en cuatro fases distintas, que el generador recorrería para asegurar que se realizara un ciclo de gaseado validado cada vez.
- Fase de deshumidificación. La humedad se reduce dentro de la cámara para proporcionar las condiciones ideales para la eliminación biológica.
- Fase de acondicionamiento. El VHP se introduce en la cámara para acumularse a niveles que permitan una buena descontaminación.
- Fase de descontaminación. La concentración de VHP se mantiene para desactivar cualquier actividad microbiológica dentro de la cámara.
- Aireación. Una vez terminada la descontaminación biológica, el VHP se retira del sistema para que no queden niveles dañinos de residuos. En este caso, se utilizó 0,4 ppm como nivel de aceptación, ya que el cliente utilizó un límite de residuos más bajo para asegurarse de que tenía un sistema robusto y no había posibilidad de contaminación de su producto debido a los residuos de gas.
El ciclo completo de descontaminación puede realizarse en tan solo cuatro minutos, aunque 20 minutos es lo más común. Para esta aplicación el proceso solo se realizaba una vez al día. Para asegurar que se produjera un ciclo robusto, se añadió tiempo adicional a cada una de las fases críticas, asegurando que se confirmara la descontaminación y se aireara el gas del sistema. Esto dio como resultado un ciclo completo de 41 minutos (tabla 1).
Aprendizaje del proyecto
La instalación está ahora en plena producción. Los beneficios iniciales previstos al principio del proyecto, como el bajo costo de capital de los equipos, una huella más pequeña y la facilidad de instalación, se han visto correspondidos por una mejor garantía de esterilidad, la facilidad de uso para los operadores y el bajo mantenimiento. El sistema es sencillo de utilizar, fácil de instalar y de validar y ha mejorado el proceso de la CDMO.
Una de las lecciones aprendidas de este proyecto fue en la etapa de dispensación. En el momento de la validación, el sistema instalado era una solución rígida y reutilizable en la que la sustancia farmacológica preesterilizada se suministraba al cliente en bolsas. Estas se abrían y luego se subdividían y se dispensaban dentro de un aislador aséptico al contenedor de transferencia previamente esterilizado y a la bioválvula. Habría sido beneficioso esterilizar el producto, el contenedor y la conexión de transferencia en un solo paso a través de la irradiación gamma, aunque esto no fue posible debido a las limitaciones asociadas a la esterilización gamma de los ensamblajes de acero inoxidable y los elastómeros como una sola pieza.
Con el lanzamiento de la gama de productos desechables/de un solo uso ChargePoint, la válvula AseptiSafe Bio se combinará con la tecnología ‘single use passive and bag’ para permitir que este proceso tenga lugar. Esto permitirá al cliente adquirir la sustancia farmacológica, la bolsa (contenedor) y el pasivo en una forma preesterilizada e irradiada con rayos gamma que puede acoplarse directamente al recipiente activo y descargarse.
Otra posibilidad es que el cliente adquiera una sustancia farmacológica no estéril, que es más fácil de manipular. Esta puede dispensarse en bolsas preesterilizadas de un solo uso, con la mitad pasiva integral de la válvula que puede acoplarse y transferir el producto. El paquete completo podría entonces ser enviado para su esterilización con rayos gamma, en lugar de tener múltiples pasos de esterilización individual y ensamblaje aséptico, haciendo de nuevo el proceso más eficiente, más fácil de manejar y más rentable.
Conclusión
Será cada vez más importante que las tecnologías de contención sean ágiles para adaptarse a la evolución de las necesidades de la producción biofarmacéutica. Se trata de un ámbito en el que las SBV pueden ofrecer considerables beneficios, debido a su flexibilidad y facilidad de aplicación.
Referencias
https://www.beroeinc.com/category-intelligence/cmoformulation-market/
| Nombre | |
|---|---|
| Empresa | Chargepoint, empresa representada por Branir |
| Cargo |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO


















































