El concepto de riesgo es muy conocido hoy en día y los principios del riesgo se aplican a varias actividades humanas y con diferentes enfoques, por ejemplo, en los negocios, las finanzas, los seguros, la sanidad pública y el sector automovilístico.
En el sector farmacéutico, la aplicación de la Gestión de riesgos (RM - Risk Management) pretende garantizar la calidad del producto, ya que el foco de atención es la seguridad del paciente. La gestión de riesgos de calidad (QRM - Quality Risk Management) es entonces un elemento valioso del sistema de calidad de las empresas farmacéuticas.
La primera pauta sobre QRM fue publicada en el 2005 y una nueva revisión entra en vigor en julio de 2023. En particular, la nueva revisión resalta la necesidad de alcanzar una comprensión más común de la aplicación de la gestión del riesgo entre diferentes partes interesadas y la necesidad de reducir el nivel de subjetividad en la evaluación del riesgo. Estos puntos son críticos para garantizar la seguridad y eficacia del producto y para asegurar su disponibilidad en el mercado. Además, tener una visión clara de lo riesgos y estar seguros de su evaluación es importante cuando hay que tomar decisiones sobre cómo y dónde invertir para mejorar el proceso de empresa.
En general, el riesgo se define como “the combination of the probability of occurrence of harm and the severity of that harm” (ICH Q9 (R1) - ISO/IEC Guide 51:2014). Ocurrencia y gravedad son lo que podemos “medir”. Y éste es el punto: "medir". El grado de subjetividad está vinculado al nivel de conocimiento y a la habilidad de medir la probabilidad de que ocurra un evento y la gravedad de su impacto. A menudo estos dos factores no se conocen y, en ciertos casos, aún peor, ni siquiera está clara la falta de conocimiento.
Si intentamos completar una lista de posibles eventos que puedan ocurrir durante un proceso, para definir los riesgos a ellos asociados, podemos reconocer que los eventos se sitúan en 4 áreas distintas (como descrito en la Figura 1):
- Área de riesgo: para estos eventos, está claro el impacto que causarán (por ejemplo, cuál atributo del producto medicinal puede verse afectado) y la gravedad de los daños asociados; además, para estos eventos es posible medir la probabilidad de que ocurran.
- Área de incertidumbre: también para estos eventos, está claro el impacto potencial y luego la gravedad del daño relacionado, pero no hay bases para medir la probabilidad de que ocurran.
- Área de ambigüedad: para estos eventos, es posible medir la probabilidad de que ocurran en modo firme, pero no tenemos conocimientos sobre el posible impacto que puedan causar y luego la incertidumbre para medir la gravedad de los daños asociados es grande.
- Área de desconocimiento: para estos eventos, no hay bases para definir el posible impacto sobre el resultado final y para medir la probabilidad de que ocurran.
Antes de evaluar correctamente el riesgo asociado a los eventos que pertenecen a las áreas de “ambigüedad”, “incertidumbre” y “desconocimiento”, éstos se tienen que mover al “área de riesgo”, para disminuir el nivel de incertidumbre y subjetividad de la evaluación del riesgo. Esto se puede hacer, por ejemplo, a través de pruebas y experimentos dedicados, para aumentar el nivel de conocimiento. Por otro lado, un evento que ya se encuentre en el “área de riesgo” se puede medir y evaluar de manera objetiva y con un menor grado de incertidumbre si la información se elabora de forma adecuada.
En este contexto, es esencial tener un enfoque sistemático para analizar un proceso y distinguir en cuál nivel de conocimiento se encuentra el evento bajo evaluación. Este método permite una evaluación objetiva del riesgo.
En nuestra opinión, la clave para alcanzar el objetivo arriba mencionado es empezar el análisis del riesgo desde un mapeo de proceso que pueda identificar claramente todos los elementos que puedan conllevar un riesgo en un proceso, y que sea capaz de indicar de manera clara la calidad del producto generado por el proceso.
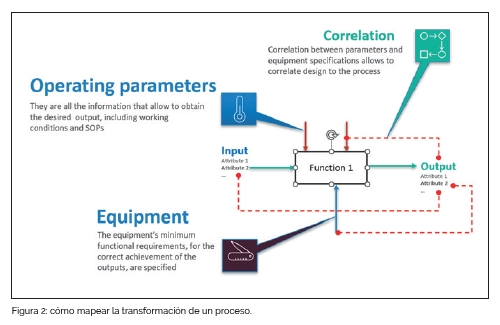
En nuestra opinión, el mapa de proceso basado en la técnica IDEF0 (presentada en detalle en el anterior artículo “Risk Management: ¿Por qué necesitamos un sistema de mapeo de procesos robusto?” de Paolo Mazzoni, PTM Consulting, publicado en el número ESPECIAL INGENIERÍA FARMACÉUTICA 2024 de Farmespaña Industrial) es la herramienta correcta para responder a estas exigencias. Esta técnica permite definir el proceso paso a paso, describiendo como las entradas del proceso se convierten en el producto final, o sea el resultado de la actividad del proceso (comúnmente llamado transformación). En la Figura 2 aparece una reproducción esquemática de cómo se puede mapear la transformación de un proceso. Durante la realización del mapa, se recopila la información sobre las características de entradas y resultado. Estas características son, por ejemplo, los atributos de calidad de los materiales entrantes, de los pasos intermedios del proceso y del producto medicinal final. Para cada transformación se introducen los parámetros operativos y el equipamiento con sus características y se relacionan con el atributo de calidad de los resultados de la función. La correlación describe cómo la calidad se puede ver afectada durante el proceso.
La información para realizar este mapa de proceso estructurado se recopila normalmente durante la fase de aportación de ideas junto al equipo de riesgo y a los expertos del proceso. Cuantos más elementos se caractericen (entradas, resultados, parámetros operativos y resultados), un mayor conocimiento del proceso estará disponible. El modelado de procesos puede distinguir claramente entre lo que sabemos, lo que creemos que sabemos y lo que no sabemos y, luego, en cuál área del conocimiento de la Figura 1 nos encontramos.
Si falta información, la empresa necesitará invertir en esfuerzos para recopilarla, con el fin de tener el proceso bajo control (véase más adelante en el artículo algunas sugerencias sobre cómo empezar a enfrentarse a este problema). Una vez recopilada la información e introducida en el mapeo de procesos, entonces todos estos datos se convierten en eventos de riesgo durante la siguiente fase de análisis del riesgo. Por ejemplo, si se utiliza la herramienta FMEA durante la evaluación de un proceso, entonces se detallarían los fallos potenciales del equipamiento o los parámetros operativos incorrectos como causas potenciales de los fallos. Esto podría dar lugar a un efecto final identificado como una falta de calidad en el producto final.
Durante la evaluación del riesgo, la medida de la gravedad está vinculada al atributo de calidad sin alcanzar, mientras que la medida de la probabilidad de que la causa ocurra está vinculada con los parámetros operativos y los fallos del equipamiento.
El sistema de mapeo descrito hasta ahora constituye entonces la base fundamental desde la que empiezan las actividades de riesgo.
Según nuestra experiencia, uno de los primeros desafíos en apoyar las empresas farmacéuticas durante el proceso de gestión de riesgos es entender correctamente las necesidades de la empresa y elegir la mejor manera de abordar un proyecto de riesgo.
Según la fase de desarrollo o la necesidad de fabricación, se podrían utilizar diferentes tipos de evaluación del riesgo y herramientas para el análisis del mismo. En todo caso, el mapeo de procesos/productos es el punto de partida y la guía para la evaluación. La información y la habilidad de estructurar el mapa y las necesidades de la empresa farmacéutica guiarán la elección del tipo de evaluación del riesgo y de la herramienta. Estos son algunos ejemplos:
- Si la empresa farmacéutica está estudiando cómo aumentar la producción de un producto medicinal desde una escala piloto a una línea comercial, la mejor solución se podría obtener realizando una evaluación del riesgo del diseño en las dos situaciones y utilizando una herramienta FMEA/FMECA para el análisis. En este caso, el punto de partida sería el mapa de los procesos del piloto y comercial, enfocados en el conocimiento del diseño de los procesos y de las decisiones tecnológicas.
- Si la empresa duda de si están bajo control todos los riesgos de un circuito no estéril causados por fallos en los sistemas CIP/SIP de una línea de llenado, entonces una evaluación del riesgo del proceso y la utilización del Análisis de Árbol de Fallos (Fault Tree Analysis) podrían ser una mejor elección. En este caso, el punto de partida será un mapa de procesos del sistema CIP/SIP de la línea y de los sistemas de control y alarma.
- Si la empresa está estudiando una nueva tecnología para un proceso conocido que se aplicará en una nueva línea de producción, el mapeo de procesos podría ser el punto de partida para explorar el conocimiento del impacto. Puede ser que se presente una falta de conocimiento sobre algún proceso operativo (por ejemplo, desde el punto de vista del objetivo y rango operativo). En este caso, las actividades de mapeo podrían permitir la definición y planificación del experimento para recopilar nuevos datos.
- Si una empresa está desarrollando una nueva formulación de un producto medicinal, el proceso de mapeo, junto a la evaluación del riesgo, puede ser utilizado come la herramienta perfecta para abordar la Calidad a través del Diseño de la fase de desarrollo, que puede enfatizar las conexiones entre Parámetros Críticos de Proceso y Atributos Críticos de Calidad y es capaz de enfatizar el conocimiento del producto. En este caso, se adoptarán tanto el diseño como la evaluación del proceso, respaldados por diferentes herramientas de análisis del riesgo. El corazón de este enfoque sigue siendo le mapeo del producto/los procesos.
Estos son sólo algunos ejemplos de los muchos campos de aplicación y de las diferentes facetas que pueda tener una gestión de riesgos bien organizada y sistemática.
Otra característica de este sistema de estructura de la información es el hecho de que se trata de un mapa en continua evolución y permite la trazabilidad. Los proyectos farmacéuticos duran años. Al principio, se encuentra el diseño del producto y del proceso de laboratorio para su realización. Años después, una vez que el producto esté listo para la producción comercial, se aumenta en gran medida la cantidad de información que se tiene que transmitir al departamento de producción. Además, la información se recopilará durante la producción, también recogiendo la valoración del mercado. Si en algún momento durante la vida del producto/proceso se lleva a cabo la evaluación del riesgo, se puede añadir fácilmente la nueva información al mapa de procesos y luego al análisis del riesgo (sin importar la herramienta de análisis del riesgo utilizada), sin empezar desde cero, ya que es un sistema de conocimiento incremental. Si se introducen cambios en el diseño/la formulación del producto o en el proceso de producción, el sistema de trazabilidad permite evaluar el cambio y la trazabilidad de la información. Esto es especialmente útil, por ejemplo, en caso de que se introduzca una nueva tecnología en una nueva línea de producción, cuando se tenga que evaluar el impacto de la nueva tecnología sobre la calidad del producto.
Al fin y al cabo, la comunicación de los resultados de las actividades de gestión del riesgo es esencial para alcanzar la “comprensión común” entre diferentes partes interesadas, requerida por ICH Q9(R1). El resultado del enfoque descrito anteriormente proporciona seguramente un análisis muy detallado. Detalles técnico y comunicación no siempre van juntos. Por el contrario, el mapa de procesos es muy comunicativo, ya que utiliza un lenguaje sencillo y común, que es completo y expresivo y permite, de esta forma, compartir la visión sobre el producto/proceso.
La experiencia en cómo organizar la evaluación del riesgo es crucial; el riesgo podría ser gastar tiempo y esfuerzo que no alcanzan el objetivo de la empresa. La elección del enfoque es crucial para obtener un resultado que sea utilizable y mantenible en el tiempo, para evitar tener una lista escasa de riesgos encerrada en un cajón.
Descarga sugerida:
Artículo escrito por:
Marisa Pedretti
,PTM Consulting



