Nociones básicas de bioequivalencia Mis
Mis estimados lectores, en este capítulo vamos a exponer unas nociones básicas sobre el concepto de bioequivalencia del medicamento genérico, para que podamos entender a los clínicos cuando nos hablan de ello, desde una perspectiva sencilla y accesible para quienes no somos expertos en el tema.
Nos centraremos en este artículo exclusivamente en formas sólidas orales, tales como cápsulas y comprimidos.
Todos hemos oído que, para que los medicamentos puedan ser considerados genéricos frente al medicamento innovador de referencia, y por lo tanto ser sustituibles y obtener las siglas EFG en el mercado español, deben ser bioequivalentes. ¿Y qué significa esto?
Antes, repasemos unos conceptos fundamentales y básicos:
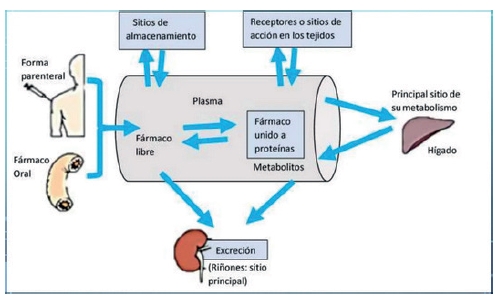
1. Todo medicamento debe ejercer su actividad farmacológica en algún punto determinado de nuestro organismo.
2. Por ello, el medicamento debe ser absorbido a nivel del sistema digestivo y pasar al torrente sanguíneo.
3. Así, el principio activo se distribuye y se dirige a la zona, receptor u órgano para el que ha sido diseñado y con el que tiene afinidad (este punto es digno de otro artículo completo...).
4. Las fases fundamentales del proceso son las conocidas como "LADME":
- Liberación
- Absorción
- Distribución
- Metabolismo
- Excreción
Esto se denomina Farmacocinética (PK) del medicamento.
5. Cada medicamento tiene su propia farmacocinética.
6. No debe confundirse con la Farmacodinamia (PD), que estudia los procesos que sufre el cuerpo debido al fármaco y las interacciones entre el fármaco y su receptor.
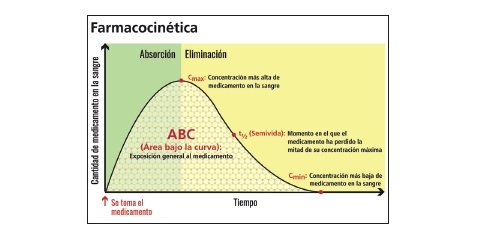
- Concentración Máxima: Es la concentración máxima que alcanza el principio activo en sangre.
- Tiempo Máximo: Es el tiempo que tarda el medicamento en alcanzar la concentración plasmática máxima.
- Concentración Mínima o Concentración Valle: Es la concentración residual antes de la administración de la siguiente dosis. Dicho valor, junto con la Concentración Máxima, determina la posología del medicamento.
- Posología: Es la dosis a la que debe administrarse un medicamento. Hace referencia tanto a la cantidad de medicamento como al intervalo de tiempo entre las administraciones sucesivas.
- Semivida Plasmática: Es el tiempo que tarda el principio activo en llegar a la mitad de su concentración máxima en plasma.
- Área Bajo la Curva (AUC o ABC): Es una medida de la cantidad de un medicamento que llega a la circulación sanguínea de una persona en un período determinado después de la administración de una dosis, desde que se toma el fármaco hasta que desaparece del plasma.
Por tanto, para que un medicamento ejerza el mismo efecto que otro, debe cumplir con las siguientes condiciones:
- A. El principio activo debe ser el mismo, incluida la misma sal.
- B. Igual potencia.
- C. Misma forma de dosificación.
- D. Mismo método de administración.
- E. Velocidad y cantidad de absorción similares.
- F. Ser probado en condiciones idénticas.
Dos medicamentos son bioequivalentes si ambos alcanzan la circulación sistémica de manera similar, logrando las mismas concentraciones en la sangre; es decir, son igualmente biodisponibles y, en consecuencia, su eficacia y seguridad son las mismas.
Profundizaremos un poco más en este concepto, pero antes debemos diferenciar lo que es una sal del principio activo y lo que es un polimorfo.
- Una sal del principio activo es la forma salina en la que se administra, por ejemplo, ibuprofeno arginato.
- El polimorfismo ocurre cuando un compuesto químico cristaliza con diferentes estructuras internas. La ICH Q6A define el polimorfismo como: "Algunas sustancias farmacológicas nuevas existen en diferentes formas cristalinas que difieren en sus propiedades físicas". Los polimorfos presentan las mismas propiedades en estado líquido o gaseoso, pero se comportan de forma distinta en estado sólido.
Es muy importante tener en cuenta que un principio activo puede presentar varios polimorfos con diferente actividad farmacológica.
Pero esto también merece un capítulo aparte...
La FDA (Food and Drug Administration) ha definido la bioequivalencia como "la ausencia de una diferencia significativa en la velocidad y cantidad en la que el principio activo o la fracción activa en equivalentes farmacéuticos o alternativas farmacéuticas se hace disponible en el sitio de acción del fármaco cuando es administrado a la misma dosis molar, en condiciones similares y en un estudio diseñado adecuadamente".
Es decir, se administra a una población de personas sanas una determinada dosis del medicamento de referencia, se extrae sangre en intervalos de tiempo específicos y se mide la Cmax, el Tmax y el AUC, términos que ya conocemos.
Después de un periodo de tiempo suficiente para que el medicamento sea eliminado del organismo (un factor previamente determinado), se administra el medicamento genérico y se vuelven a medir los mismos valores: Cmax, Tmax y AUC.
En este punto, es importante mencionar que los clínicos juegan un papel crucial al determinar el tipo de ensayo de bioequivalencia en función del conocimiento del principio activo, sus sales, polimorfos, la serie LADME y otros factores, como los perfiles de disolución in vitro y la clasificación BCS del fármaco. Todo esto permite diseñar un estudio de bioequivalencia óptimo y lo más económico posible, lo cual está directamente relacionado con el número de individuos (N) que participan en el estudio.
Como dato informativo, en España, para un estudio normal de bioequivalencia, cada participante (N) cuesta aproximadamente 5.000 euros, mientras que en India este costo es de unos 1.000 euros.
La Agencia Europea del Medicamento (EMA) propone, como criterio para la toma de decisiones de bioequivalencia, la determinación del intervalo de confianza del 90% (nivel de significación, α=0,05) de cada uno de los parámetros farmacocinéticos evaluados (AUC, Cmax y Tmax) en la formulación que pretende demostrar bioequivalencia, y su inclusión en el intervalo del 80-120% con respecto al medicamento de referencia. Este intervalo corresponde al 80-125% cuando los datos son transformados logarítmicamente.
La FDA utiliza un enfoque en el que se evalúa si el límite inferior del intervalo de confianza es igual o superior a 0,8 y/o si el límite superior es igual o inferior a 1,25. El nivel de significación, α, también es de 0,05.
La UE también recomienda la determinación del intervalo de confianza al 90% para el parámetro Tmax mediante un método no paramétrico. Las agencias reguladoras consideran este intervalo del ±20% como aceptable desde el punto de vista clínico para la mayoría de los medicamentos. La prueba de bioequivalencia establece que podemos concluir que dos tratamientos no son diferentes entre sí si el intervalo de confianza del 90% de la relación de una medida de exposición transformada logarítmicamente (AUC y/o Cmax) cae completamente dentro del rango del 80-125%.
Desde un punto de vista estadístico, para calcular el intervalo de confianza del 90% se utilizó el cuartil t de Student con un nivel de significación α/2 = 0,05 (t(0,05, 4) = 2,13).
El intervalo de confianza calculado (IC del 90% = 96-108%) también se encontró dentro de los límites de aceptación del 85-115%.
¿Qué significa esto? Simple:
Se considera que dos fármacos son bioequivalentes si los valores de AUC y Cmax están dentro de los límites de -20% y +25% para un intervalo de confianza del 90%.
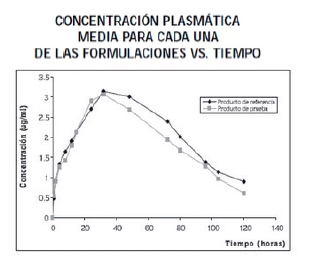
Por ello, solo el AUC y Cmax deben cumplir la regla, no así el Tmax, como es el caso de las formulaciones de acción rápida, como las efervescentes, las de dispersión oral y otras formas.
En la siguiente tabla, tomada de la AEMPS, se estructuran las diferencias según el país:
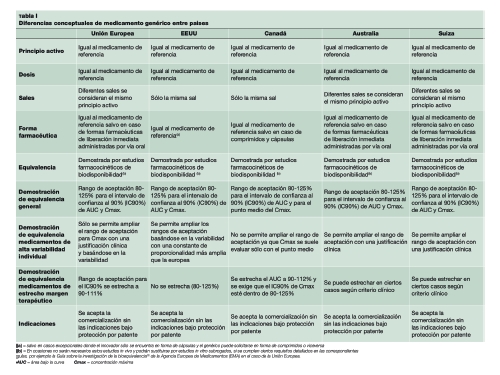
Evidentemente, el tema es más complejo, pero espero, estimados lectores, que haya sido útil. Si es así, me sentiré satisfecho; y si no, ya sabéis dónde encontrarme.
| Nombre | Eduardo Sanz |
|---|---|
| Empresa | Pharmaceutical industry |
| Cargo | Senior Adviser |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO

















































